Obat baru pertama dalam hampir dua dekade untuk melawan penyakit Alzheimer, Senin (7/6), mendapat persetujuan bersyarat dan kontroversial dari regulator obat Amerika Serikat (AS).
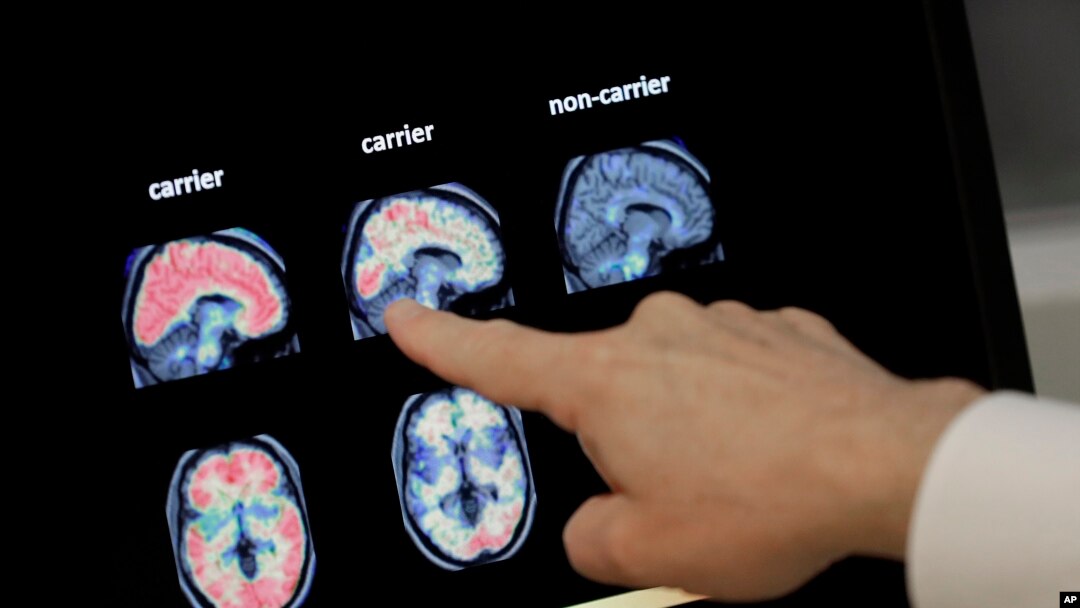
Badan Pengawas Makanan dan obat-obatan AS (Food and Drugs Administration/FDA) menyetujui obat antibodi perusahaan Biogen, aducanumab. Obat ini mengurangi plak amiloid yang mengacaukan otak pasien Alzheimer.
Namun persetujuan tersebut menuai kritik tajam dari para ahli yang mencatat bahwa perusahaan tersebut belum membuktikan obat itu memperlambat penurunan kognitif yang melemahkan pada pasien penyakit tersebut.
FDA akan meminta Biogen untuk terus menguji obat itu setelah dipasarkan dan pada akhirnya menunjukkan bahwa pasien benar-benar membaik dengan obat tersebut.
Sementara itu, Biogen mengatakan biaya obat itu $56 ribu per pasien per tahun, tetapi kemungkinan akan ditanggung oleh sebagian besar perusahaan asuransi, termasuk Medicare.
Menurut Organisasi Kesehatan Dunia, Alzheimer, penyakit penurunan fungsi syaraf menyebabkan sekitar dua pertiga dari 50 juta kasus demensia di seluruh dunia.
Aducanumab, dipasarkan sebagai Aduhelm, adalah pengobatan pertama yang disetujui untuk menarget proses penyakit penyebab Alzheimer daripada hanya mengobati gejalanya.
Dalam dua uji klinis, aducanumab mengurangi plak amiloid sebesar 59 persen sampai 71 persen setelah 18 bulan.
Namun, penelitian tersebut dihentikan lebih awal karena tidak menunjukkan bahwa penurunan fungsi otak pasien yang memakai aducanumab lebih lamban daripada pasien yang tidak memakainya.
Biogen mengevaluasi kembali data dari sebagian pasien dalam satu percobaan dan mendapati sedikit peningkatan pada pasien yang menerima dosis tertinggi.
FDA memutuskan untuk menyetujui obat dalam apa yang disebut persetujuan yang dipercepat, di mana standar pembuktiannya yang lebih rendah daripada persetujuan penuh. FDA mengatakan data Biogen menunjukkan bahwa mengurangi plak amiloid "sangat mungkin bermanfaat secara klinis."
"Jalur ini memungkinkan FDA untuk memberikan pasien, yang menderita penyakit serius, akses lebih awal ke obat yang berpotensi berharga meskipun masih ada beberapa ketidakpastian mengenai manfaat klinis obat," kata Patrizia Cavazzoni, direktur Pusat Evaluasi Obat dan Riset FDA kepada wartawan. [my/ka]